El síndrome respiratorio y reproductivo porcino (PRRS) sigue constituyendo una de las mayores amenazas para la industria porcina mundial.
Dentro del arsenal de herramientas para el control del virus del PRRS (PRRSV) se incluyen las medidas de bioseguridad internas y externas, manejo e higiene, además de la vacunación.
La estabilización de los lotes de cerdas, es decir, la limitación de la circulación del virus entre las mismas, es de capital importancia en la epidemiología del virus en la explotación.
Está claramente demostrado que la circulación del virus PRRSV en el post-destete está relacionada con los trastornos reproductivos asociados al mismo en las cerdas y que, incluso en condiciones de flujo continuo en la fase de post-destete, cuando la población de cerdas es estable, es probable que la circulación del virus no se produzca o sea limitada hasta las 9-10 semanas de vida.1
En la actualidad, se dispone de dos tipos de vacunas: vacunas vivas modificadas o atenuadas (MLV) y vacunas inactivadas (INV) o muertas (KV).
Todavía se encuentra en fase experimental la fabricación de vacunas mediante otras tecnologías de producción de antígenos.
La mayoría de las vacunas contienen sólo antígenos de uno de los genotipos, es decir, del tipo 1 (anteriormente conocido como tipo europeo) o del tipo 2 (o tipo americano).
Las vacunas inactivadas utilizadas en EE. UU. son básicamente vacunas autógenas o autovacunas (CMV). La fracción antigénica de estas vacunas contiene el virus PRRS aislado de una explotación, de una granja contigua o, si hay relación epidemiológica, de una explotación no contigua o incluso de un aislamiento lo menos heterogéneo posible.
En las pruebas de laboratorio, se redujo de forma significativa la viremia tras el desafío homólogo y heterólogo en animales vacunados con vacunas vivas (MLV)2.
Cuando la cepa vacunal y la de desafío pertenecen al mismo genotipo, el nivel de protección disminuye a medida que decrece la homología genética3.
Sin embargo, tras la vacunación con vacunas vivas, Prieto et al. (2008)4 demostraron variabilidad en la protección frente a las cepas de desafío PRRSV del mismo genotipo, incluso siendo cercanas desde el punto de vista genético, lo cual indica que la protección cruzada no solo está relacionada con el tipo sino que también ha de ser considerada de un aislamiento a otro.
![]()
-
Se demostró que una de las vacunas inactivadas de tipo 1 (PROGRESSIS®, Ceva) indujo la producción de células secretoras de INF-γ específico frente al PRRSV tras la estimulación ex vivo tanto con cepas PRRSV de tipo 15,6como con una de tipo 27
-
Asimismo, en una prueba de campo a gran escala realizada con dicha vacuna en 17 granjas durante dos ciclos reproductivos completos, se demostró que se redujo la viremia tras el desafío homólogo8, así como la prevalencia de ésta en lechones al destete9
-
Se ha demostrado también que la vacunación repetida con PROGRESSIS® produce anticuerpos seroneutralizantes10 y refuerza la producción de dicho tipo de anticuerpos frente a las cepas heterólogas que circulan libremente en las explotaciones11.
Sin embargo, por lo general, un segundo contacto con el virus vivo produce un mínimo efecto booster, es decir, no se observa un aumento de los títulos de anticuerpos seroneutralizantes ni de la inmunidad celular específica.
Por otra parte, se ha observado que los programas vacunales que incluyen solo vacunas inactivadas son efectivos en ciertas condiciones: vacunación a largo plazo con vacunas inactivadas a mitad de la gestación9, 12, 13 o vacunación en sábana cada 3 meses14.
Sin embargo, la opinión generalizada es que ninguno de los protocolos de vacunación existentes basados en la utilización de una sola vacuna ofrece una protección efectiva y duradera a largo plazo.
El sistema de vacunación basado en la sensibiliza- ción del sistema inmune con un tipo de vacuna y el refuerzo inmunitario mediante otro tipo de vacuna se ha utilizado en varias especies para hacer frente a diversos patógenos, por ejemplo, BVD15 o BRSV16 en ganado vacuno, o FMDV en porcino17.*
El objetivo de este artículo es revisar varias pruebas de investigación y estudios que demuestran el beneficio de los programas de vacunación mixtos con vacuna viva e inactivada, tanto en términos de respuesta inmunitaria como de control de la circulación del virus PRRS de campo y la consiguiente mejora de los índices productivos.
Pruebas de laboratorio
Hace una década, varios investigadores demostraron mediante pruebas de laboratorio18 y ensayos de campo19 que el empleo de una vacuna inactivada del tipo 2 (PRRomiSe® , actualmente no comercializada) producía un aumento significativo de la respuesta inmunitaria frente al PRRSV gracias a los programas vacunales que incluían una vacuna viva de tipo 2 y dicha vacuna inactivada/p>
Se realizó un estudio comparativo20 de la respuesta inmunitaria inducida tanto por una vacuna viva atenuada como por la combinación de dicha vacuna viva y otra inactivada, ambas del tipo 120 (Diaz, I., et al. 2013).
El diseño experimental fue como se describe a continuación: se tomaron 32 lechones y se distribuyeron de forma aleatoria en cuatro grupos (Tabla 1).
*BVD: Virus de la diarrea bovina / BRSV: Virus respiratorio sincitial bovino / FMDV: Virus de la fiebre aftosa
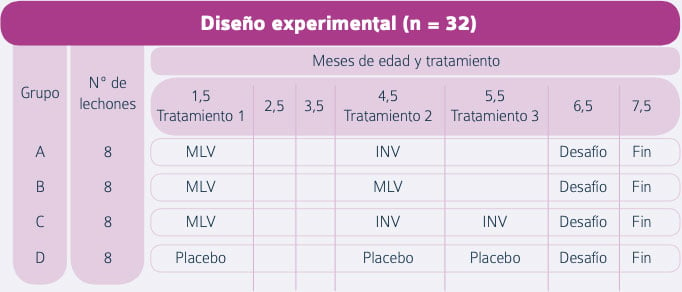
Tabla 1. Diseño experimental para la prueba (Diaz et al.)
- Se administró una vacuna viva de tipo 1 frente al PRRS a los lechones de los grupos A, B y C a la edad de 1,5 meses, mientras que los animales del grupo D se mantuvieron sin vacunar como grupo control.
- A los 4,5 meses de edad, los lechones de los grupos A y C recibieron una dosis de PROGRESSIS® (2 ml por vía IM), mientras que a los del grupo B se les administró una segunda dosis de vacuna viva.
- A los 5,5 meses de edad, los lechones del grupo C recibieron una dosis adicional de PROGRESSIS® por la misma vía.
- A los 6,5 meses de edad, todos los lechones fueron desafiados por vía intranasal mediante una suspensión de 2 ml en medio salino que contenía 106 dosis infectivas de cultivo de tejido 50 (TCID50) del virus PRRS de tipo 1, cepa 2749 (99% de similitud con el virus Lelystad en base a las secuencias de la ORF5).
Sin embargo, se observó un aumento significativo de los títulos AN tras el desafío en el grupo C (Tabla 2), es decir en los animales que habían recibido una doble revacunación con vacuna inactivada, en comparación con el grupo control no vacunado y con el grupo que solamente había recibido una revacunación con vacuna viva.
Se analizaron los anticuerpos ELISA, los seroneutralizantes (AN) y la inmunidad celular (CMI), así como la viremia tras el desafío. La revacunación con PROGRESSIS® produjo respuestas ELISA similares a la revacunación con vacuna viva, sin un efecto booster aparente (datos no mostrados).
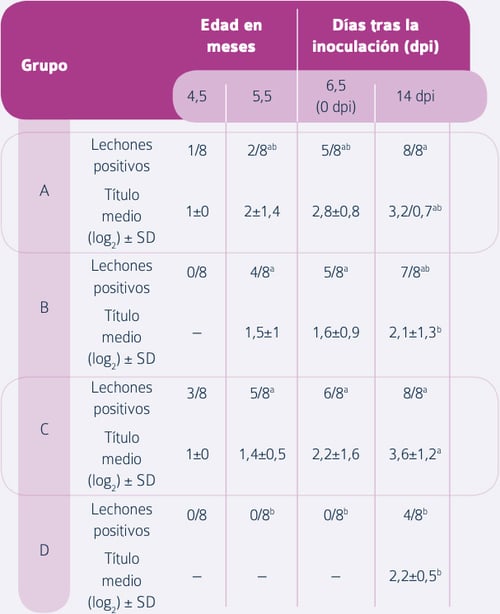
Tabla 2. Determinación de anticuerpos neutralizantes. Los resultados se expresan como proporción de animales positivos y título medio (log2) ± SD para los lechones positivos. Un valor de superíndice distinto en la misma columna indica que hay diferencias estadísticamente significativas (P < 0,05) entre grupos con respecto a la proporción de lechones positivos o el título medio en un momento concreto (Diaz et al.).
Los lechones que fueron revacunados con una sola dosis de vacuna inactivada mostraron títulos AN intermedios.
El empleo de programas combinados (vacuna viva + PROGRESSIS®) fue más eficaz que el de vacuna viva en cuanto a la inducción de inmunidad celular, tanto tras la vacunación como considerando la respuesta inmunitaria observada después del desafío (Figura 1).
Tras éste, la protección frente al virus fue similar en los tres grupos (datos no mostrados).
Por el contrario, la revacunación con una dosis de vacuna inactivada indujo una respuesta significativamente más elevada en cuanto a la inmunidad celular y numéricamente más elevada de los títulos de anticuerpos seroneutralizantes. Tras la vacunación con dos dosis de vacuna inactivada, separadas un mes, se observó una mejor respuesta de la inmunidad celular y de los anticuerpos seroneutralizantes, tanto antes como después del desafío.
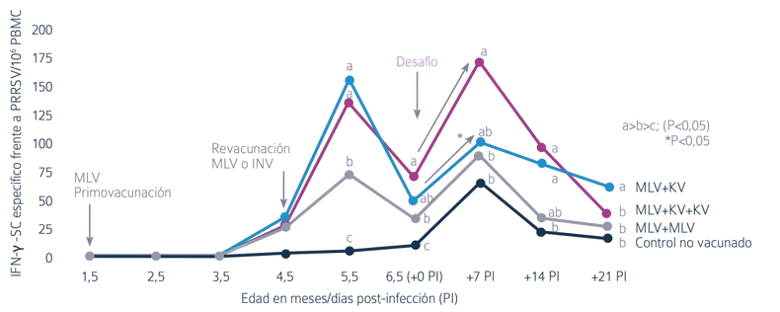
Figura 1. Células secretoras de INF-γ específico frente al PRRS para cada momento de muestreo. Una letra distinta en la misma vertical implica una diferencia significativa al nivel p<0,05 (Diaz et al.)
En conclusión, este estudio confirma que, tanto las vacunas vivas frente al PRRSV como el desafío natural, producen una débil respuesta inmunitaria medida tanto en base a los anticuerpos seroneutrali- zantes AN específicos frente al PRRSV como según las células productoras de INF-γ.
También se confirmó que una segunda dosis de la misma vacuna viva a un intervalo de 3 meses no produjo un efecto booster significativo en la inmunidad humoral según los títulos ELISA o sero- neutralizantes ni en la inmunidad celular, evaluada mediante la cuantificación de las células productoras de INF-γ específico frente al PRRS.
De forma práctica, la combinación de una primera dosis sensibilizante con vacuna viva en las cerdas jóvenes y posteriores revacunaciones con una vacuna inactivada produjo unos niveles superiores de anticuerpos seroneutra- lizantes y de inmunidad celular con la consecuente repercusión que tiene todo ello sobre la protección frente al virus PRRS.
PRUEBAS DE CAMPO
PRUEBA 1
El objetivo de la primera prueba21 fue evaluar el impacto de la aplicación de una dosis adicional de PROGRESSIS® a las cerdas el día 90 de gestación (D90) sobre el aumento de los títulos de anticuerpos maternales frente al PRRS en los lechones y su eventual beneficio sobre el curso de la infección del PRRSV en dichos animales durante el período de transición.
Los datos se obtuvieron en una granja de ciclo cerrado de 300 madres con un buen manejo, localizada en una de las zonas con mayor densidad porcina de los Países Bajos.
En esta explotación, se venían observando desde hacía tiempo problemas relacionados con el PRRSV en transición a pesar de que las madres se vacunaban con una vacuna viva de tipo 1 cada ciclo reproductivo, 6 días después del parto.
El programa de vacunación se modificó como sigue: se mantuvo la vacuna viva en lactación y se añadió una primovacu- nación y revacunación en masa inicial con sendas dosis de PROGRESSIS® separadas 3 semanas pasando después a revacunar con dicha vacuna el día 90 de gestación
Se tomaron muestras de suero en 3 lotes de lechones (2/3 lotes vacunados con PROGRESSIS®) a las 4, 7 y 10 semanas de edad para posteriormente analizar los anticuerpos frente al PRRSV mediante la prueba ELISA (Idexx) y la prueba IPMA
Se tomaron muestras de fluido oral de los lechones de más edad (7 y 10 semanas de edad) de los dos últimos lotes y se analizaron mediante una prueba Multiplex PCR frente a patógenos respiratorios.
Antes de la puesta en marcha de la vacunación adicional con la vacuna inactivada, se confirmó mediante prueba serológica que en el lote había circulación del PRRSV entre las 5 y las 10 semanas de edad.
Tras la vacunación con PROGRESSIS®, los anticuerpos de origen maternal frente al PRRSV fueron más elevados y de mayor duración y no se observó seroconversión frente al virus en los lechones hasta, al menos, las 8 semanas de edad (Tabla 3).
Con esta vacunación adicional, el PRRSV no se detectó en los fluidos orales durante el período de transición, excepto en un lote a las 10 semanas de edad.
A pesar de que estos resultados deben interpretarse con ciertas reservas debido a la baja especificidad de la prueba Multiplex PCR, la ausencia del virus en los fluidos orales junto con la ausencia de seroconversión en la fase de transición en 2 lotes consecutivos indica que la vacunación con PROGRESSIS® inmediatamente antes del parto puede ser eficaz para inducir una inmunidad pasiva prolongada y reducir la infección temprana en los lechones.
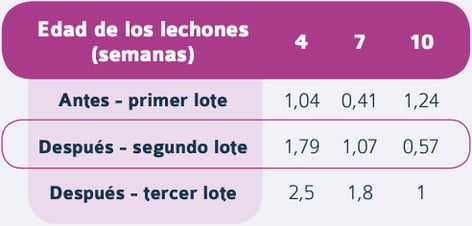
Tabla 3. Resultados S/P ELISA frente al PRRSV en lechones antes y después de la introducción de una dosis adicional de vacuna PROGRESSIS® el D90 de gestación (Dekens et al.)
PRUEBA 2
La segunda prueba de campo22 se realizó en una granja de ciclo cerrado con 1.200 madres y 5 lotes de producción.
Cuando aparecieron los problemas, las cerdas jóvenes y adultas se vacunaban en sábana de forma rutinaria 3 veces al año con una vacuna viva modificada de tipo 1 frente al PRRSV. Los lechones en transición se alojaban en 2 naves grandes.
En enero de 2012, se observaron signos clínicos graves relacionados con el PRRSV. En las naves de reproducción se observaron partos prematuros y un elevado número de mortinatos, así como lechones nacidos débiles.
En la fase de transición, los resultados productivos eran desfavorables y asociados a una elevada tasa de mortalidad (4,5%) y a un aumento anormal del uso de antibióticos.
Antes de la puesta en marcha del nuevo programa de vacunación, los datos serológicos de ELISA (Idexx) confirmaron la circulación del PRRSV en lechones (Tabla 4) y en cerdas jóvenes y adultas (Tabla 5). Mediante PCR, también se detectó el virus PRRS en muestras de sangre de lechones de 3 y 7 semanas de edad.
En noviembre de 2012, tras aproximadamente 11 meses desde el inicio de este nuevo programa vacunal, se observó una estabilización clínica y serológica de la circulación del PRRSV en los lechones en transición (Tabla 4).
En ese mismo período, los datos de serología de las cerdas adultas y jóvenes indicaban todavía una circulación reciente del PRRSV (títulos > 3)
El programa vacunal de las cerdas adultas se sustituyó por una vacuna viva atenuada (MLV) de tipo 1 el día 60 de gestación combinada con el uso de PROGRESSIS® el día 90
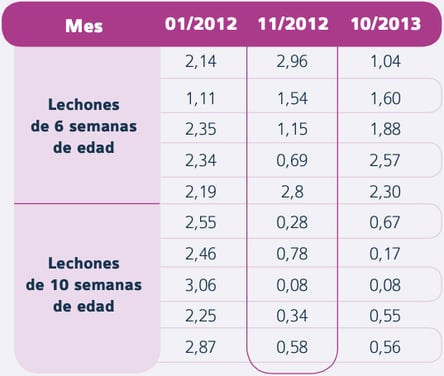 Tabla 4. Índice S/P ELISA frente al PRRSV en muestras serológicas de lechones de 6 y 10 semanas de edad entre enero de 2012 y octubre de 2013 (Defoort et al.)
Tabla 4. Índice S/P ELISA frente al PRRSV en muestras serológicas de lechones de 6 y 10 semanas de edad entre enero de 2012 y octubre de 2013 (Defoort et al.)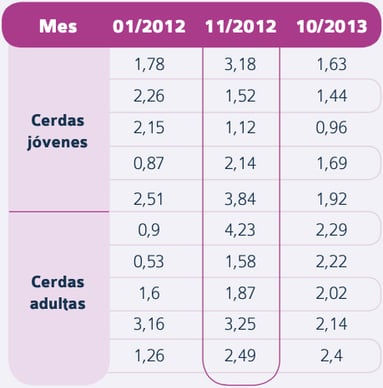 Tabla 5.Índice S/P ELISA frente al PRRSV en muestras serológicas de cerdas jóvenes y adultas entre enero de 2012 y octubre de 2013 (Defoort et al.)
Tabla 5.Índice S/P ELISA frente al PRRSV en muestras serológicas de cerdas jóvenes y adultas entre enero de 2012 y octubre de 2013 (Defoort et al.)
![]()
En octubre de 2013, tras 22 meses de utilización continuada de PROGRESSIS® en cerdas adultas y jóvenes el día 90 de gestación, los títulos en las cerdas también fueron homogéneos (tabla 5), mientras que la S/P ratio en lechones al final de transición presentó un valor bajo.
A finales de 2013, el índice de mortalidad en transición se redujo a ≈ 2%. Tras el comienzo de la vacunación con PROGRESSIS® el día 90 de gestación, se produjo una cierta mejora rápida de los resultados productivos en el período de transición. Además, al cabo de 22 meses se observó una notable estabilización de la circulación del PRRSV en las cerdas adultas y jóvenes.
En diciembre de 2013, se confirmó la infección por PRRSV en dos lotes de transición mediante los resultados positivos de las pruebas de PCR y seroconversión ELISA (Idexx) tanto en suero como en fluidos orales.
Las camadas de las cerdas vacunadas con vacuna inactivada no mostraron ningún síntoma respiratorio hasta el momento del sacrificio. Todos los resultados de la prueba ELISA menos uno (índice S/P 0,66 a las 8 semanas de edad) fueron negativos a las 8 y 12 semanas de edad
Los resultados positivos ELISA, tanto en sueros como en fluidos orales a las 16 semanas de edad, mostraron que la circulación del PRRSV se había retrasado hasta después del final del período de destete
En enero de 2014, uno de los lotes de reproductoras recibió una dosis adicional de la vacuna INV frente al PRRSV (PROGRESSIS®) el día 90 de gestación. Se tomó una cohorte de 10 lechones procedentes de estas reproductoras y se hizo un seguimiento para detectar la presencia de la infección por PRRSV (PCR en fluidos orales) y serología (ELISA) a las 8, 12 y 16 semanas de edad.
Como conclusión, estos resultados indican que la vacunación con PROGRESSIS® el día 90 de gestación puede ser eficaz para incrementar la inmunidad de origen materno en los lechones y controlar la circulación del virus con el fin de conseguir estabilizar toda la explotación.
PRUEBA 3
La tercera prueba de campo23 se llevó a cabo en una granja de ciclo cerrado de 400 madres localizada en Bretaña (Francia), positiva frente al PRRSV con 5 tandas de partos de 80 animales
Las cerdas adultas se vacunaban durante la lactación con una vacuna viva de tipo 1 frente al PRRSV. No se observaban signos clínicos en la fase de lactación.
Los lechones se vacunaban frente a M. hyopneumoniae al destete y no se vacunaban frente al PRRSV.
Los trastornos respiratorios se producían de forma recurrente en las naves de transición y de cebo, por lo cual necesitaban aplicar tratamientos antibióticos frecuentes.
En febrero de 2014, las cerdas adultas se vacunaron siguiendo su protocolo habitual (solo el día 6 de lactación con una vacuna viva atenuada), y los síntomas respiratorios volvieron a observarse en la transición, lo cual sugería una infección temprana por el PRRSV.
En junio de 2014, se volvió a utilizar la vacuna inactivada el día 90 de gestación como práctica rutinaria, lo cual redujo los signos clínicos respiratorios en los animales.
En octubre de 2014, la toma de muestras transversal de fluidos orales puso en evidencia la persistencia de anticuerpos maternales hasta las 10 semanas de edad y la ausencia de circulación del virus de PRRS hasta las 12 semanas de edad.
Se tomaron muestras de 6 cerdas a las 4, 3 y 1 semanas previas al parto para determinación de los títulos ELISA (Idexx). Para cada cerda, se seleccionaron de forma aleatoria 3 lechones de su camada a los que se tomaron muestras de sangre a las 4, 7 y 10 semanas de edad.
Se determinaron los anticuerpos frente al PRRSV y el ARN vírico mediante ELISA (Idexx) y RT-PCR, respectivamente.
Antes y después del cambio en el programa vacunal, se controlaron los signos clínicos y los datos técnicos de la explotación.
La prueba de RT-PCR en lechones destetados demostró la presencia del PRRSV en fluidos BAL y en suero, retrasándose desde las 4 a las 10 semanas de edad tras la puesta en marcha del programa mixto de vacunación con vacuna viva e inactivada.
En conclusión, bajo las condiciones de campo de esta prueba, la introducción de un programa vacunal mixto frente al PRRSV en cerdas adultas, mediante la combinación de una vacuna viva atenuada el día 6 de lactación y PROGRESSIS® el día 90 de gestación produjo un retraso de la circulación del virus PRRS y una clara reducción de los signos clínicos respiratorios asociados. Estos resultados demuestran que la vacunación con PROGRESSIS® unas 3 semanas antes del parto puede ser eficaz en el control de la circulación temprana del virus en lechones y en la estabilización de toda la explotación.
PRUEBA 4
La cuarta prueba de campo24 se realizó en una granja holandesa de ciclo cerrado con 1.000 madres donde los lechones mostraban signos clínicos respiratorios relacionados con el PRRSV entre las 4 y las 10 semanas de edad, confirmados mediante la prueba de PCR en fluido de lavado broncoalveolar (BAL) a partir de las 4 semanas de edad.
Los lechones no estaban vacunados frente al PRRSV. La vacunación de las cerdas adultas comprendía el uso de una vacuna viva de tipo 1 el día 6 después del parto y el día 60 de gestación. Se sustituyó por una vacunación con la vacuna viva el día 60 de gestación y una revacunación con PROGRESSIS® el día 90 de gestación.
A lo largo de un año tras la instauración del nuevo programa vacunal se realizaron tomas de muestras de fluido BAL en lechones de 4 a 10 semanas de edad y se analizó el ARN del PRRS mediante RT-PCR.
Se observó una mejora significativa de los signos clínicos en los lechones destetados. En las cerdas adultas se observó una disminución de los títulos de anticuerpos frente al PRRSV entre las 4 y 3 semanas antes del parto y un fuerte incremento tras la vacunación con PROGRESSIS®.
Se observó una correlación positiva entre los títulos de anticuerpos en las cerdas adultas una semana antes del parto y los de los lechones a las 4 semanas de edad, lo cual mostraba un buen manejo del encalostramiento.
La inmunidad de origen maternal en los lechones decreció de forma gradual desde las 4 a las 10 semanas de edad, lo cual indica la ausencia de una infección de campo del PRRSV.
![]()
Tras la modificación del programa vacunal de las cerdas, los resultados productivos de la explotación mejoraron en varios parámetros: el número de nacidos vivos aumentó de 32,2 a 34,7 y el número de lechones destetados por año de 28,2 a 31. En el grupo de lechones destetados, la ganancia media diaria de peso aumentó desde 302 a 320 g/día y la mortalidad post-destete decreció de 4,7 a 0,8%.
En las condiciones de la prueba, la puesta en marcha de la vacunación con PROGRESSIS® al final de la gestación redujo y retrasó la circulación del virus PRRS entre los lechones destetados, al mismo tiempo que mejoró de forma significativa los datos productivos de la explotación y los signos clínicos consecutivos a la infección por el virus.
En tales granjas, el programa de vacunación habitual frente al PRRSV antes de la introducción de la vacunación adicional con vacuna inactivada en las reproductoras, incluía una primovacunación con una vacuna viva de tipo 1 en cuarentena seguida de revacunaciones el día 6 de lactación y el día 60 de gestación o bien vacunación en sábana cada 4 meses con dicho tipo de vacuna.
Se incorporó al programa vacunal habitual de la explotación la vacunación de las cerdas adultas con PROGRESSIS® el día 90 de gestación. Se determinó la presencia de infección por PRRSV y los títulos de anticuerpos por medio de la toma de muestras de fluido oral en lechones.
La determinación de títulos de anticuerpos frente al PRRSV se realizó mediante una prueba comercial (Idexx PRRS OF Ab Test, valor OD >0,4 para positividad) y la presencia de ARN mediante la técnica de RT-PCR (LSI VetMAX™, valor CT <40 para positividad).
Antes y después de la introducción de las dosis adicionales de vacuna inactivada en cerdas adultas, se realizaron 8 estudios de seguimiento transversal y 14 estudios de seguimiento longitudinal de lotes de lechones con 3-5 muestras de fluido oral por lote a partir de las 5-7 semanas de edad (en total 81 muestras).
La circulación del virus se retrasó hasta la fase final del cebo (11/23 muestras fueron positivas a partir de las 14 semanas de vida). Los lechones procedentes de las madres vacunadas con vacuna inactivada mostraron unos títulos de anticuerpos ELISA significativamente más elevados tras el destete que disminuyeron de forma gradual hasta las 11-16 semanas de vida, dependiendo del lote.
Por tanto, la seroconversión se retrasó hasta unas pocas semanas después de la entrada de los lechones en las naves de cebo (datos no mostrados)
La Figura 2 muestra que no se detectó el ARN del PRRSV en las muestras de fluido oral de los lechones procedentes de las cerdas vacunadas con vacuna inactivada hasta las 13 semanas de vida.
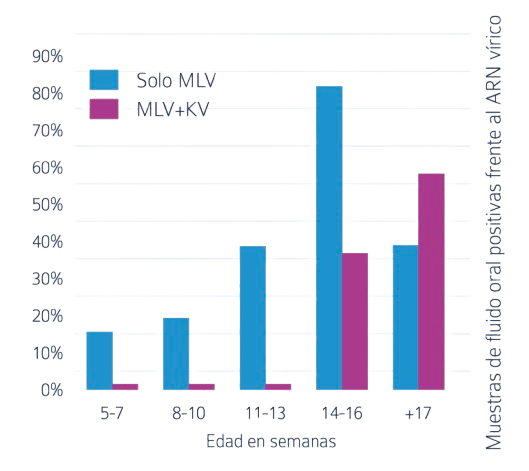
Figura 2. Porcentaje de muestras de fluido oral positivas frente al ARN de PRRSV en lechones de diferentes grupos de edad en un estudio realizado en 7 granjas.
Estudio comparativo entre un programa de vacunación basado únicamente en vacuna viva y otro mixto con vacuna viva e inactivada (Boivent et al.)
Conclusiones
Las pruebas de campo realizadas en distintos lugares y condiciones donde se producía la circulación del PRRSV en lechones jóvenes confirman los estudios de investigación sobre los programas mixtos de vacunación con vacunas vivas e inactivadas que demuestran una mejor estimulación de los mecanismos inmunitarios que, supuestamente, están relacionados con la protección frente al PRRSV, es decir, con los anticuerpos seroneutralizantes y las células secretoras de INF-g específico frente al PRRSV.
Asimismo, dichos estudios también demuestran que una sola dosis de vacuna inactivada aplicada al final de la gestación, como complemento de varios planes vacunales en las cerdas basados en vacunas vivas, retrasa la circulación del virus en los lechones procedentes de las mismas y, en muchos casos, la pospone hasta que los lechones entran en las naves de cebo.
- Una mejor transferencia de la inmunidad maternal
- Una reducción de la contaminación de los fetos/ lechones durante las semanas previas y posteriores al destete de los lechones recién nacidos
Como consecuencia, se mejora de forma significativa el estado sanitario y la productividad de los lechones, mostrando un mayor índice de crecimiento, una menor mortalidad y, por tanto, un menor consumo de tratamientos antibióticos.
Además, desde un punto de vista inmunológico, el post-destete es la fase en la cual se completa el desarrollo del sistema inmune de los lechones.
El post-destete es también la fase de inmunización frente a otros muchos patógenos (PCV2, M hyo, APP, FMD, CSF, etc.)*. Por tanto, se considera como un efecto muy favorable para proteger a los lechones frente a un potente virus inmunomodulador.
*PCV2: Circovirus porcino tipo 2 / M. hyo: Micoplasma hyopneumoniae / APP: Actinobacillus pleuropneumoniae / FMD: Fiebre aftosa / CSF: Peste porcina clásica
Bibliografía
1. Candotti, P., et al. (2006). Proc. 19th IPVS Cong, Vol 1: 54. Relationship between piglet PRRS seroprevalence at the end of nursery and reproduction disorders due to PRRS in sows, København, Denmark. P O.02-01.
2. Martelli, P., et al. (2009). Vaccine. 27(28): 3788-3789. Efficacy of a modified live porcine reproductive and respiratory syndrome virus (PRRSV) vaccine in pigs naturally exposed to a heterologous european (Italian cluster) field strain: clinical protection and cell-mediated immunity.
3. Mateu, E., et al. (2008). The challenge of PRRS immunology. Vet J. 177(3):345-51
4. Prieto, C., et al. (2008). Vet J., 175 (3): 356-363. Similarity of European porcine reproductive and respiratory syndrome virus strains to vaccine strain is not necessarily predictive of the
degree of protective immunity conferred.
5. Piras, F., et al. (2005). Viral Immunology, 18(2): 381-389. Porcine reproductive and respiratory syndrome (PRRS) virus– specific interferon-+ T-cell responses after PRRS virus
infection or vaccination with an inactivated PRRS vaccine.
6. Zuckermann, F., et al. (2007). Vet Microbiol. 123 (2007) 69–85. Assessment of the efficacy of commercial porcine reproductive and respiratory syndrome virus (PRRSV) vaccines based on measurement of serologic response, frequency of gamma-IFN-producing cells and virological parameters of protection upon challenge.
7. Charreyre, C., et al. (2007). Proc. 5th Int. Symposium on Emerging and Re-emerging Pig Diseases, Krakow, Poland, p144. Ex-vivo stimulation with different PRRSV strains for cellular mediated immunity monitoring of PROGRESSIS® vaccinated pigs.
8. Reynaud, G., et al. (2004). 18th IPVS Cong., Hamburg, Germany. 1: 429. Homologous PRRSV challenge after vaccination with an inactivated PRRS vaccine: PROGRESSIS® Merial.
9. Reynaud, G., et al. (1999). Proc. 3rd Int. Symposium on PRRS and Aujeszky disease. p281-282. Evaluation in the field of serological and virological efficacy of an inactivated PRRS vaccine in sows.
10. Joisel, F., et al. (2007). 5th Int. Symposium on Emerging and Re-emerging Pig Diseases, Krakow, Poland, p 219. Evaluation of neutralizing antibodies in pigs repeatedly vaccinated with PROGRESSIS® (Merial) an inactivated vaccine against PRRSV.
11. Geldhof , M. F., et al. (2013). Vet Microbiol. 167(3-4):260-271. Antibody response and maternal immunity upon boosting PRRSV-immune sows with experimental farm-specific and commercial PRRSV vaccines.
12. Papatsiros, V. G., et al. (2006). Journal of Vet Medicine. 53: 266-272. Long-term administration of a commercial porcine reproductive and respiratory syndrome virus (PRRSV)-inactivated vaccine in PRRSV-endemically infected sows.
13. Joisel, F., et al. (2001). The Pig Journal. 48: 120-137. PRRS: Vaccination with a killed vaccine; Field experience.
14. Bardini, R. (2014). Proc. 6th ESPHM. p19. Benefits of PROGRESSIS® vaccination in PRRS control, a field experience.
15. Reber, A. J., et al. (2006). Comparative Immunology, Microbiology & Infectious Diseases 29: 61-77. Evaluation of multiple immune parameters after vaccination with modified live or killed bovine viral diarrhea virus vaccines.
16. Letellier, C., et al. (2008). Vaccine. 26 (37): 4840-4848. Vaccination of calves using the BRSV nucleocapsid protein in a DNA prime-protein boost strategy stimulates cell-mediated immunity and protects the lungs against BRSV replication and pathology.
17. Li, Y., et al. (2008). Vaccine. 26 (21): 2647-2656. Dramatic improvement in FMD DNA vaccine efficacy and crossserotype antibody induction in pigs following a protein boost.
18. Nilubol, D., et al. (2004). Vet Microbiol. 102 (1-2): 11-18. The effect of a killed porcine reproductive and respiratory syndrome virus (PRRSV) vaccine treatment on virus shedding in previously PRRSV infected pigs.
19. Bassaganya-Riera, J., et al. (2005). Viral Immunology. 17 (1): 25-37. Impact of immunization with porcine reproductive and respiratory syndrome virus on lymphoproliferative recall response of CD8+ T cells.
20. Díaz, I., et al. (2013). Vet J. 197(2):438-44. Comparison of different vaccination schedules for sustaining the immune response against porcine reproductive and respiratory syndrome virus.
21. Dekens, V., et al. (2013). Proc. 5th ESPHM. p190. Induction of maternal immunity by vaccination of sows at end of gestation with PROGRESSIS®.
22. Defoort, P., et al. (2014). Proc. 23rd IPVS Cong. p565. Stabilization of PRRSV circulation in a farm using a vaccination program with PROGRESSIS® at the end of gestation.
23. Willems, L., et al. (2015). Proc. 7th ESPHM. p165. Stabilization of PRRSV circulation in a nursery and fattening unit following the implementation of mixed PRRSV vaccine program in breeders.
24. Spaans, J., et al. (2016). 24th IPVS/8th ESPHM cong., Dublin, Rep. of Ireland. Effect of Dual Technology Prime Boost (DTPB) vaccination in sows on circulation of PRRSV in post-weaning piglets.
25. Boivent, B., et al. (2016). 24th IPVS/8th ESPHM cong., Dublin, Rep. of Ireland. PRRS Dual Technology mix vaccination program (MLV/ KV): virus circulation monitoring in pig flows using oral fluids.
Publicado en porcinews




