Mycoplasma hyopneumoniae (Mh) a été identifié comme pathogène du porc il y a bientôt 60 ans. C’est une petite bactérie sans paroi qui contamine l’arbre respiratoire des porcs. Mh est présent dans la plupart des élevages et joue un rôle central dans la pathologie respiratoire.
Quelles sont les pathologies à Mycoplasma hyopneumoniae ?
On distingue 3 formes de pathologies selon que Mh est le seul agent responsable ou qu’il est associé (Maes, Sibila et Pieters, 2020) :
- La mycoplasmose : c’est la forme la moins fréquente. On l’observe lorsqu’un élevage ou un lot de cochettes dites naïves se contaminent avec Mh uniquement et pour la première fois.
- La pneumonie enzootique : c’est la forme « classique » qui se traduit généralement par de la toux et une dégradation des performances de croissance en engraissement. Dans ce cas, l’infection initiale à Mh est souvent suivie de surinfections bactériennes notamment par des pasteurelles.
- Le Complexe Respiratoire Porcin (CRP) : c’est une forme grave car due à un complexe multi-infectieux. Dans ce cas, l’infection à Mh s’accompagne d’une co-infection par le circovirus porcin de type 2 (PCV2), le virus du syndrome dysgénésique et respiratoire porcin (SDRP).
Comment Mycoplasma hyopneumoniae induit une pathologie respiratoire ?
Mh est responsable de la destruction de l’arbre muco-cillaire des bronches, système de défense naturel de l’arbre respiratoire. Il fragilise donc les défenses non spécifiques, met à nu la muqueuse bronchique et favorise ainsi les surinfections. Les signes cliniques sont observés après le développement des lésions pulmonaires.
Quels sont les facteurs de risque ?
Outre les co-infections déjà évoquées, on peut citer :
- Le nombre de souches présentes : plus il y a de souches différentes dans un même élevage, plus la pathologie est sévère (Michiels et al., 2017).
- Les facteurs qui favorisent la diffusion de Mh : les animaux se contaminent avant tout par voie oro-nasale (contacts directs ; air). Mh se transmet lentement entre animaux mais durablement car les porcelets peuvent rester très longtemps infectieux ce qui peut rendre sa diffusion insidieuse. Des mélanges de porcelets, des mélanges de bandes, sont alors des facteurs de risque majeurs. De même que des circuits d’air inappropriés (par exemple, une salle qui reçoit de l’air d’une autre). Ces facteurs sont important à connaître pour mettre en place une prévention efficace.
Cas des infections précoces à Mycoplasma hyopneumoniae
Ces cas s’expliquent par cette longue persistance de l’infectiosité. Deux cents jours après infection, soit plus de 6 mois après, des porcs sont encore capables de transmettre du Mh à leurs congénères ! (Pieters et al., 2009)
Ainsi des cochettes naïves introduites dans un élevage ne vont pas apporter de nouvelle souche mais elles vont finir par rencontrer Mh et se contaminer. Avec cette période infectieuse pouvant dépasser les 6 mois, elles risquent donc de contaminer leurs porcelets en maternité. C’est ce qu’on appelle une dynamique d’infection précoce (cf l'illustration ci-dessous : contact truie porcelet et transmission verticale).

En fonction des élevages, Mh contamine alors les porcelets plus ou moins tôt (de la maternité à l’engraissement). Mais plus Mh se développe tôt, pire est son impact (Fano et al., 2007)
Les facteurs qui favorisent l’expression clinique de Mycoplasma hyopneumoniae
Parmi eux, on peut citer des défauts de ventilation. Ainsi, l’ammoniac, NH3, qui se concentre en cas de sous ventilation affecte lui aussi l’arbre muco-cillaire.
Mais surtout, l’action de Mh est dose dépendante (Marois et al., 2010) : plus un animal se contamine avec une charge élevée, plus les lésions et les signes cliniques se développent rapidement et de manière importante.
Quels sont les signes cliniques et les lésions associées ?
La clinique est une toux sèche, qui se développe le plus souvent en engraissement, et qui peut s’accompagner d’une chute d’appétit. Cette toux devient grasse en cas de surinfections.
Les lésions correspondent à une consolidation du tissu pulmonaire, de consistance proche de celle du foie, et d’une couleur rouge à grise. Elles cicatrisent avec le temps sous forme d’un sillon en rétraction.
Comment diagnostiquer Mycoplasma hyopneumoniae ?
La suspicion se fait d’abord au vu des symptômes cliniques. On peut ensuite confirmer le diagnostic avec des analyses de laboratoire et des contrôles pulmonaires à l’abattoir en réalisant une notation des lésions pulmonaires (cf illustration ci-dessous).
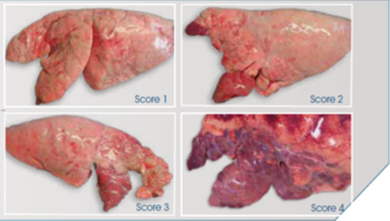
Illustration : notation de lésions de pneumonie à l’abattoir de score 1 à score 4 (Grille Madec ; photos Institut IZSLER, Italie).
Quelles sont les conséquences techniques et économiques ?
Les pertes économiques sont liées à l’ampleur des lésions pulmonaires qui induisent des retards de croissance et une baisse de l’indice de consommation ainsi qu’aux éventuels traitements mis en place.
Un repère sommaire est : un point de notation pulmonaire à l’abattoir correspond à 500 g de poids vif en moins à l’abattoir. Or près de 20% des élevages contrôlés ont une note moyenne supérieure à 3 (Leneveu et al., 2021). A cela s’ajoute l’impact sur l’indice, moins visible mais plus pénalisant économiquement. Et ce, d’autant plus que l’aliment est cher (Aubry et al., 2010).
Références bibliographiques
- Aubry et al., 2010. Incidence technico‐économique des maladies pulmonaires. Journées Recherche Porcine, 53-58
- Deblanc et al., 2012. Pre-infection of pigs with Mycoplasma hyopneumoniae modifies outcomes of infection with European swine influenza virus of H1N1, but not H1N2, subtype. Veterinary Microbiology 157, 96–105
- Leneveu et al., 2021. Bilan de trois années de contrôles pulmonaires Ceva Lung Program sur plus de 600 000 porcs. Congrès annuel AFPVP, 39-40
- L’helgouach et al., 2018. PCR et Histologie sur poumons : prélever à l’abattoir pour aller au-delà du score pulmonaire. Congrès annuel AFPVP, 113-114.
- Maes, Sibila et Pieters 2020. Mycoplasma in Swine. Acco Edition. 344 pages.
- Marois et al., 2009. Experimental infection of SPF pigs with Actinobacillus pleuropneumoniae serotype 9 alone or in association with Mycoplasma hyopneumoniae. Veterinary Microbiology 135,283–291
- Michiels et al., 2017. Impact of diversity of Mycoplasma hyopneumoniae strains on lung lesions in slaughter pigs. Michiels et al. Veterinary Research 48:2
- Pieters et al., 2009. An assessment of the duration of Mycoplasma hyopneumoniae infection in an experimentally infected population of pigs. Veterinary Microbiology 134, 261–266
- Sorensen et al., 1997. Mycoplasma hyopneumoniae infection in pigs: Duration of the disease and evaluation of four diagnostic assays. Veterinary Microbiology 54, 23–34
